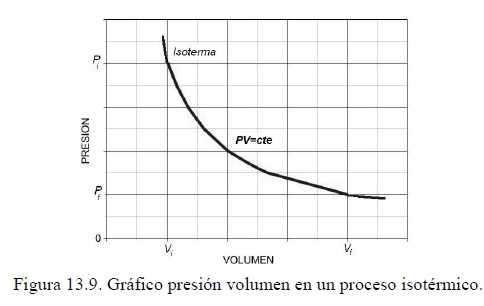
Un proceso isotérmico es aquel que se realiza a temperatura constante. La gráfica de P versus V para un gas ideal, manteniendo la temperatura constante es una curva hiperbólica llamada isoterma (figura 13.9). Como la energía interna de un gas ideal es solo función de la temperatura, entonces en un proceso isotérmico para un gas ideal ΔU = 0 y Q = W.
Se calculará el trabajo para un gas ideal que se expande isotérmicamente desde el estado inicial i al estado final f, como se muestra en el gráfico PV de la figura 13.9. La isoterma es una curva hiperbólica de ecuación PV = cte. El trabajo realizado por el gas se puede calcular con la ecuación 13.5, usando la ecuación de estado de gas ideal, PV = nRT, para reemplazar P:
Como la temperatura es constante, se puede sacar fuera de la integral:
Ejemplo 13.9 Calcular el trabajo realizado por un mol de un gas ideal que se mantiene a 0º C, en una expansión de 3 litros a 10 litros.
Solución: como la expansión es isotérmica, el cálculo es directo reemplazando los datos en la ecuación 13.8:
Se observa que casi todo el calor se usa para cambiar la energía interna de la barra de cobre. Por esta razón, normalmente en la dilatación térmica de un sólido o un líquido se desprecia la pequeña cantidad de trabajo realizado contra la atmósfera.




Comentarios
Publicar un comentario