Suponga ahora que el gas se lleva por un proceso termodinámico isobárico, desde i hasta f2, como se muestra en la figura 13.10. En esta trayectoria, la temperatura aumentó en la cantidad ΔT. El calor que se debe transferir al gas en este proceso está dado por Q = n cP ΔT, donde cP es la capacidad calórica molar a presión constante. Como el volumen aumenta en este proceso, se tiene que el trabajo realizado por el gas es W = P ΔV, y aplicando la primera ley de la termodinámica, se obtiene:
En este caso el calor agregado al gas se usa en dos formas: una parte para realizar trabajo externo, por ejemplo para mover el émbolo del envase y otra parte para aumentar la energía interna del gas. Pero el cambio de energía interna para el proceso de i hasta f2 es igual en el proceso de i hasta f1, ya que U para un gas ideal dependen sólo de la temperatura y ΔT es la misma el cada proceso. Además como PV = nRT, para un proceso de presión constante se tiene que PΔV = nRΔT. Reemplazando en la ecuación 14.5, con ΔU = n cV ΔT, se obtiene:
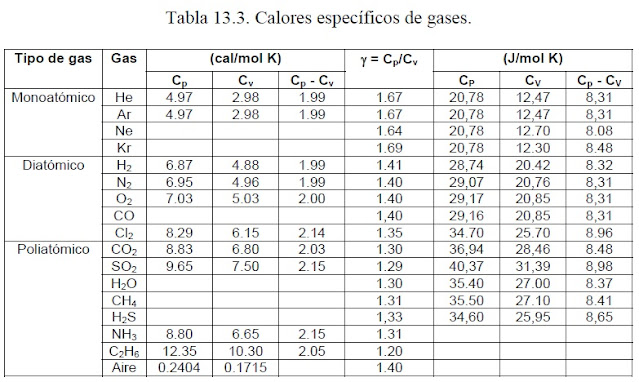
Esta expresión que se aplica a cualquier gas ideal, indica que la capacidad calórica molar a presión constante es mayor que la capacidad calórica molar a volumen constante por una cantidad R, la constante universal de los gases. Como para un gas monoatómico cV = (3/2)R = 12.5 J/molK, el valor de cP es cP = (5/2)R = 20.8 J/molK. La razón de estas capacidades calóricas es una cantidad adimensional llamada gamma, γ, de valor:


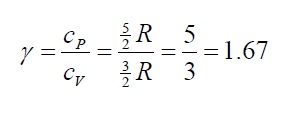
Comentarios
Publicar un comentario